MENU
El “pH” en las Aguas Residuales, un parámetro muy conocido pero poco aprovechado por los operadores.
February 6, 2024

El término “pH” proviene del latín “Potentia HYDROGENIi” que se puede traducir como “el poder 💪 del hidrógeno” y fue descubierto a principio de los 1900 y mide la acidez de una sustancia.
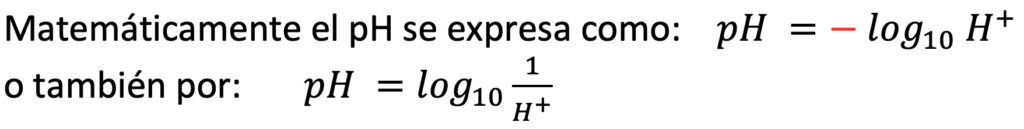
En síntesis, se divide 1 entre la concentración de iones de hidrógeno en la solución y se le aplica el logaritmo base diez en la calculadora. Aunque convencionalmente el pH se maneja en unidades, en realidad se mide en milimoles por litro (mmol/L).
El mol es la unidad utilizada para contar los átomos y moléculas. Así como el papel viene en resmas, los huevos en docenas y los zapatos en pares, los átomos y moléculas vienen en moles. Un mol contiene 6.022 x 1023 átomos o moléculas. Un milimol es la milésima parte de un mol o 6.022 x 1023 átomos o moléculas. La razón de esta cifra tan grande se debe a que los átomos y moléculas son tan pequeños que se necesita una gran cantidad de ellos para poder medirlos con exactitud. 1 mol de átomos de hidrogeno pesa 1.00794 gramos.
Gracias a Dios 🙏 que hay aparatos para medir el pH y el operador no tiene que hacer cálculos engorrosos y complicados 😫 pero el operador debe de entender que
debido a que el pH se expresa en escala logarítmica, toma un cambio grande en la concentración de iones de hidrógeno para producir un cambio pequeño en la lectura del pH…🤔 💭…
en la práctica esto significa que aunque la escala de pH incrementa o disminuye de uno a uno, cada unidad representa un cambio de 10 veces debido a la escala logarítmica, un pH de 6 es 100 veces menor que pH de 8 😳.
Ya que hablamos de escalas ⚖️…
El pH mide la concentración (o actividad) de iones de hidrogeno en la solución. La escala del pH va de 0 a 14, valores debajo de 7 se consideran ácidos y valores arriba de 7 se consideran básicos, el valor de 7 es neutro.

A un pH de 6 comienzan a morir especies de peces como la trucha y el salmón 😰, y a un pH de 4.2 mueren 💀 todas las especies de peces 😵.
Los operadores 👷🏼♂️ deben estar conscientes que las mediciones de pH por si solas no son la mejor forma para el control efectivo del sistema de tratamiento, y que estas mediciones deben de ir acompañadas por mediciones de alcalinidad
(veremos la alcalinidad en otro blog).
Con frecuencia cuando un cambio de pH se hace notorio, ya el proceso se ha degradado significativamente y se vuelve más difícil restablecerlo al rango normal de operación.
Las aguas residuales crudas tienen un pH cercano a 7, aunque las descargas industriales y otras descargas no domésticas pueden causar que el pH se eleve o disminuya grandemente.
Existen otras condiciones que pueden causar alteraciones en el pH como las condiciones anaeróbicas, las cuales deprimen el pH.
Valores bajos de pH ⬇️ junto con otras observaciones, como olor a huevo podrido 🤢 y el color gris oscuro o negro de las aguas residuales, son indicativos de condiciones sépticas en la red de alcantarillado o en la planta de tratamiento.
El pH es importante en los procesos de tratamiento biológicos y químicos.
La mayor parte de microorganismos 🦠 permanecen suficientemente activos dentro de un rango de pH estrecho, generalmente entre 6.5 y 8.0; fuera de este rango, el pH puede inhibir o cesar por completo la actividad biológica.
Los procesos de precipitación química 🧪 funcionan mejor dentro rangos estrechos de pH, que difieren dependiendo del químico utilizado en la precipitación.
Adicionalmente, los permisos de vertido 💦 generalmente exigen un rango de pH entre
[6.5 – 9.0] antes de la descarga final.
Es importante que el operador tenga el criterio adecuado de cuándo y donde medir…
En algunos casos los procesos productivos de las empresas 🏭 utilizan químicos 🧪 en sus materias primas que pueden alterar transitoriamente el pH y por ende dar una medida incorrecta (no representativa)…
o el caudal de aguas residuales puede atravesar una trampa de grasas 🧈 sin el adecuado mantenimiento y cambiar el pH del agua… obteniéndose un pH erróneo para efectos de diseño
el operador debe de medir el pH no menos de 2 veces diarias, a la entrada, a la salida, y en puntos importantes para la eficiencia del proceso.
El químico más utilizado para aumentar el pH es el hidróxido de sodio Na(OH).
El químico más utilizado para reducir el pH es el ácido sulfúrico H2SO4.
Hay varias formas de medir el pH:
– El método del electrodo y métodos colorimétricos.
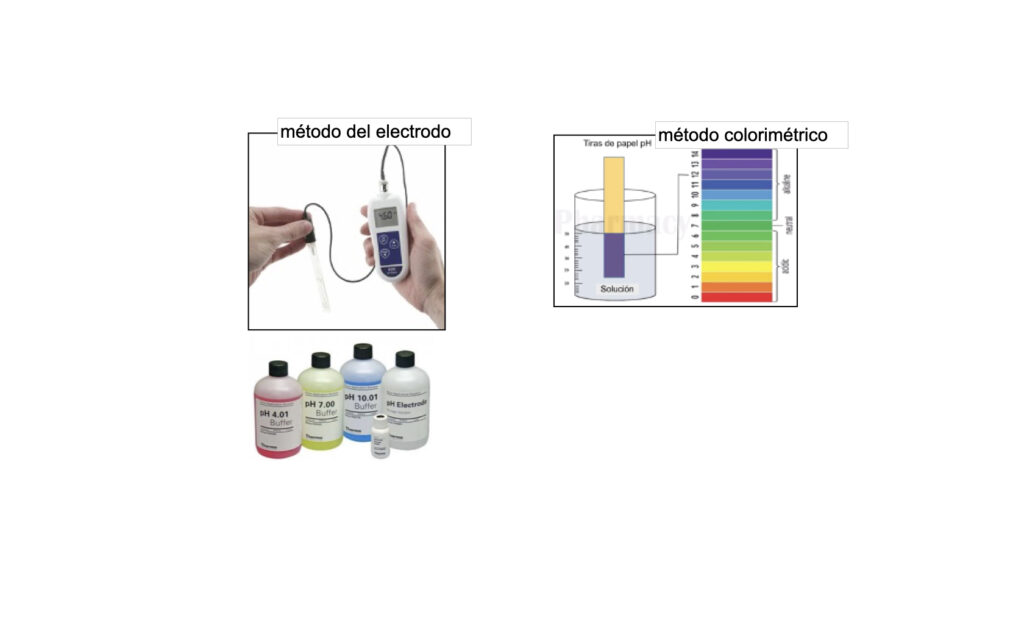
El método del electrodo es más preciso y es el más comúnmente utilizado pero el operador debe de entender que
sin una limpieza y calibración diaria tendera a dar valores equivocados.